银屑病是一种慢性的、T细胞介导的炎症性皮肤病,影响全球约2%的人口。调节性T细胞(regulatory T cells ,Tregs)是参与银屑病发生的重要免疫细胞,Tregs参与维持免疫稳态和诱导免疫耐受,是表达关键转录因子FoxP3的CD4+T细胞亚型,具有CD25高表达和CD127低表达的特点。大约1-3%的外周血单核细胞(peripheral blood mononuclear cells ,PBMCs)是CD4+CD25+FoxP3 Tregs,超过60%的循环Tregs表达皮肤淋巴细胞相关抗原(cutaneous lymphocyte-associated antigen,CLA)。CLA是一种重要的皮肤归巢受体,它与血管凝集素内皮细胞-白细胞粘附分子1结合,在最近一项研究中,提出建议将CLA+T细胞作为管理银屑病的潜在免疫标记物。
最近的研究已经表明,银屑病患者的Tregs功能出现障碍。这种Tregs功能障碍可能是促炎细胞因子环境造成的,炎症信号如IL-1β、IL-6、IL-21和IL-23的存在,以及转化生长因子β(transforming growth factor-β,TGF-β)水平较低的情况下,Tregs转化为Th17样的表型。这些细胞因子还诱导STAT3磷酸化,导致Tregs功能障碍。有研究表明多种因素如FoxP3的遗传多态性、microRNA的表达增加以及Th17/Treg比例的失衡,均可导致Tregs功能出现障碍,表现为抑制炎症的能力降低。但是,使用高通量方法对银屑病Tregs进行分子特征分析,尤其是关于Tregs迁移至皮肤炎症部位的皮肤归巢倾向,尚未被阐明。
2024年2月,来自韩国首尔延世大学(Yonsei University College of Medicine)的Tae-Gyun Kim教授团队在EBioMedicine上发表了文章High-dimensional profiling of regulatory T cells in psoriasis reveals an impaired skin-trafficking property。该研究使用飞行时间流式细胞技术(Cytometry by time of flight ,CyTOF),进行高通量、高维单细胞表征,深度分析Treg细胞亚群的特异性标记物,对比银屑病患者和健康人样本Tregs(尤其是循环CLA+ Tregs)的表型差异,为Tregs在银屑病发病机制中的作用提供了有价值的见解。

在这项研究中,研究者对比银屑病患者和健康人样本 PBMCs 中的 Treg 和单核细胞亚群的差异,使用单细胞测序对所有样本中的免疫细胞类型进行注释。银屑病样本中 CD4+ Tregs (CD25+ CD127- FoxP3+) 显著增加(图 1c),三种类型的单核细胞都显著减少 (CD14+ CD16-、CD14- CD16+和CD14+ CD16+)(图 1c)。
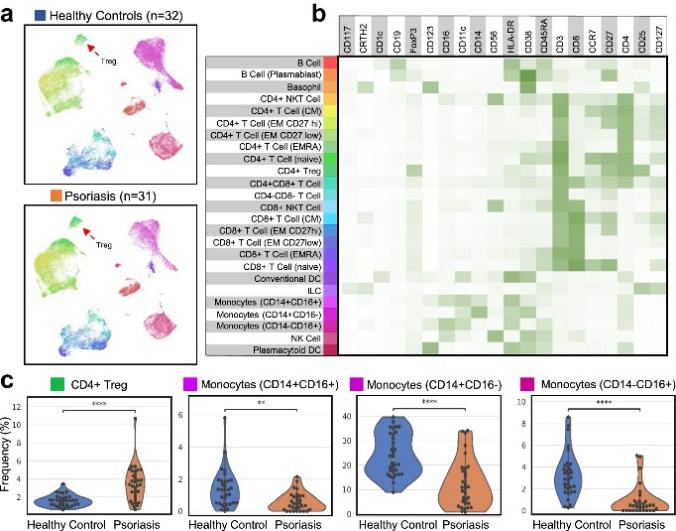
研究者使用Leiden 算法对银屑病样本和健康供体样本进行聚类分析。Treg 亚群主要通过 CLA 表达差异分类(图 2b),银屑病组中 CLAhi Tregs 的频率显著降低(图 2c 和 2d)。在进一步分析 CLAhi Tregs亚群时,发现银屑病样本中 CD39low CCR5hi Tregs 显著降低 (图 2e 和 2f)。CCR5+ Tregs 的调节功能更强,并且在银屑病 PBMCs 中,CCR5+ Tregs 的频率、迁移能力和抑制炎症能力显著降低。进一步发现CLAhi CD39low CCR5hi Tregs减少,表明银屑病 Tregs 归巢到皮肤炎症区的倾向可能降低。
银屑病 PBMC 中显示活化表型的CLAhi Ki-67hi HLA-DRhi Tregs 的频率降低(图 2e 和 2f),并以 CTLA-4 和 ICOS 的高表达为特征(图 2b)。Treg 聚类分析还揭示了表达 Th1 相关趋化因子受体 CXCR3 的 CLAhi Tregs 亚群在银屑病组中显著降低。在 CLAlow Treg 亚群内,研究者观察到 CD39hi CCR5hi、CD39hi CCR5low 和 CCR7hi Tregs 显著增加 (图 2e 和 2f)。
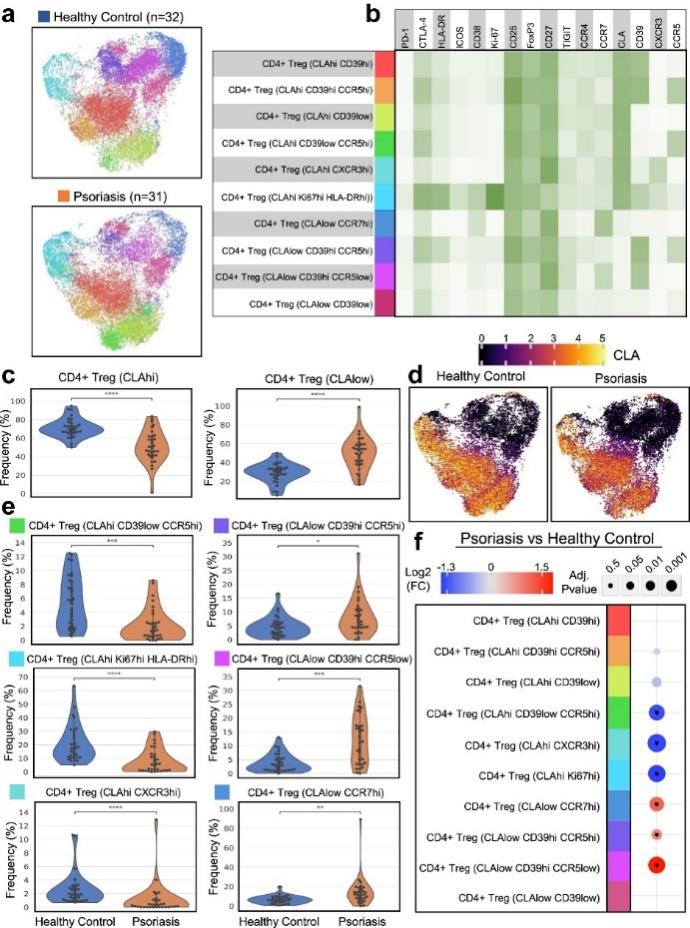
研究人员评估了银屑病和健康供体样本之间总 Tregs 和 CLAhi Tregs 的Treg 功能标记物和趋化因子受体的差异表达。对总 Tregs 的差异标记物分析显示,与健康供体相比,银屑病患者的再循环标记物 CCR7 表达显著升高。相比之下,包括 CLA、CCR4、CCR5 和 CXCR3 在内的皮肤归巢相关标记物的表达显著降低 (图 3a 和 3b)。
CLA是 T 细胞募集到皮肤的关键分子,研究者进一步分析了 CLAhi Treg亚群。他们发现该群细胞CCR7 表达增加 ,CLA 、 CCR4 、 CCR5 和 CXCR3 表达降低 (图 3a 和3b)。这些发现与 Leiden 算法分析的结果一致,显示与健康对照相比,银屑病中 CLAhi CXCR3hi 和 CLAhi CD39low CCR5hi Treg 亚群频率下降。
此外,研究者还发现在银屑病组中多个 Treg 功能标记物升高。在总 Tregs 中,银屑病患者中 FoxP3 表达显著增加 。在 CLAhi Treg亚群内,银屑病患者中FoxP3、CTLA-4 和 CD39 表达显著增加 (图3c)。
考虑到 CCR7 在银屑病循环 Tregs 中的表达持续上调,研究者试图在银屑病皮肤微环境中检测这种表型。他们发现银屑病病变皮肤中的 Tregs 的 CCR7 表达总体增加,免疫荧光表明银屑病 Tregs 有离开皮肤并重新进入循环的趋势(图3d 和3e)。为了验证这一发现,研究者对从银屑病样本和健康供体样本 PBMCs 中分离的 Tregs 进行体外迁移测定,发现与健康供体 Treg 相比,银屑病 Tregs 向 CCR7 的配体 CCL19 和 CCL21 (10 μg/ml 和 100 μg/ml) 的浓度依赖性迁移显著增强(图 3f)。

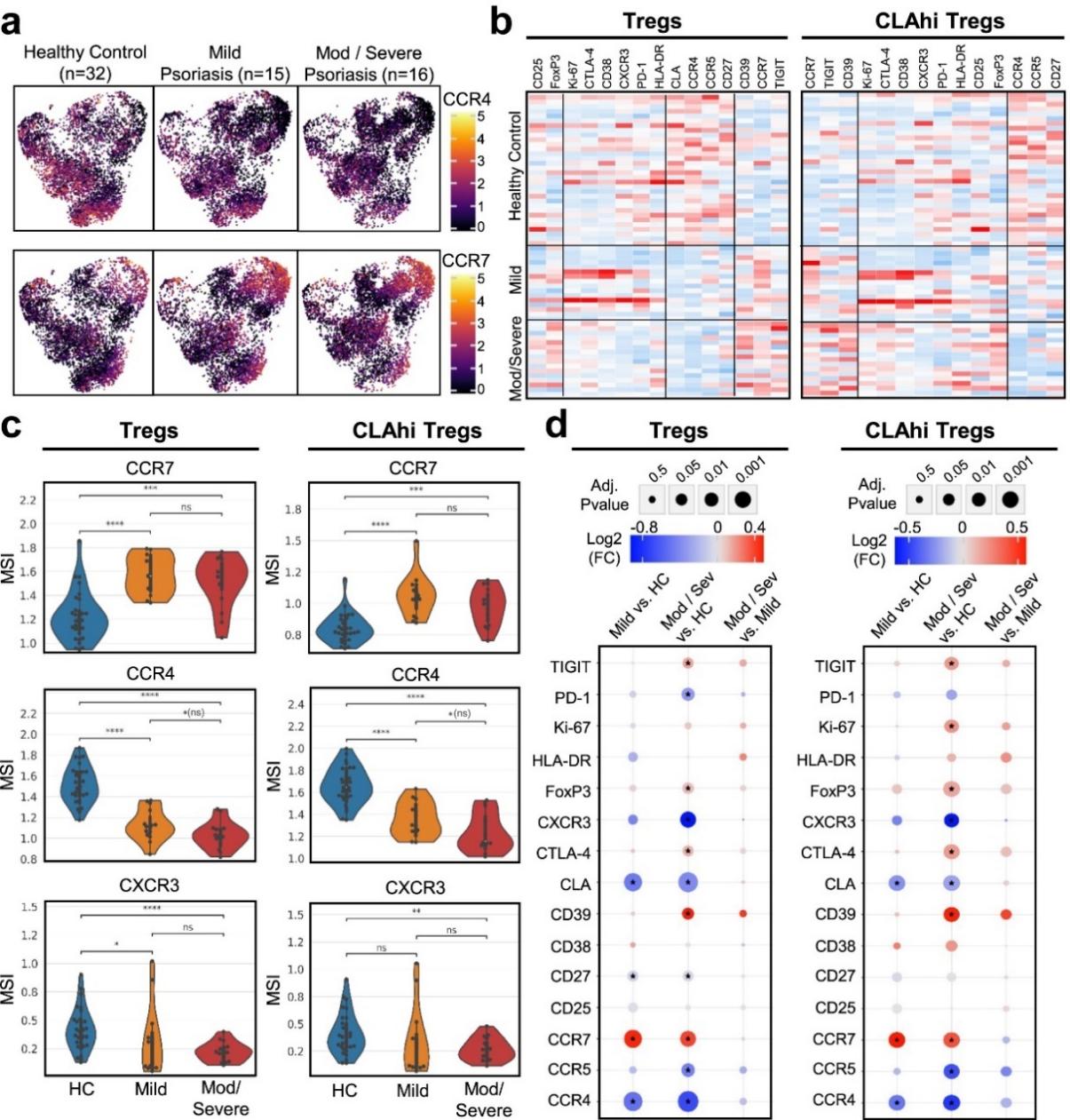
随后,研究者按严重程度(轻度:PASI 5-10;中度至重度:PASI >10)对银屑病 PBMCs 进行再分组,并在不同严重程度组和健康供体之间进行配对比较,以分析总 Tregs 和 CLAhi Tregs趋化因子受体和功能标记物表达的变化与银屑病严重程度的关系。与健康对照相比,轻度组Tregs 中的 CCR4 显著降低(图 4a 和 4b)。随着疾病严重程度增加,CCR4降低更显著,在中重度银屑病组中观察到CCR4下降最显著。轻度和中重度银屑病组之间 Tregs 上的CCR4表达有所降低。 CLAhi Treg亚群中CCR4表达显著减少。与健康对照相比,轻度和中重度银屑病的 CCR7、CXCR3 和 CLA 表达有所增加,但轻度银屑病和中重度银屑病组之间没有显著差异(图4c和4d)
在 Treg 功能标志物中,与健康对照相比,轻度银屑病组中 Treg 上的 FoxP3 、 CD39 、 TIGIT 和 CTLA-4 表达没有显著增加。然而,与健康对照相比,中重度银屑病组的FoxP3 、 CD39 、 TIGIT 和 CTLA-4 表达显著增加,表明疾病严重程度与这些标记物的上调相关,这些标记物在程度最严重疾病组的 Tregs 上表达最高(图 4d)。
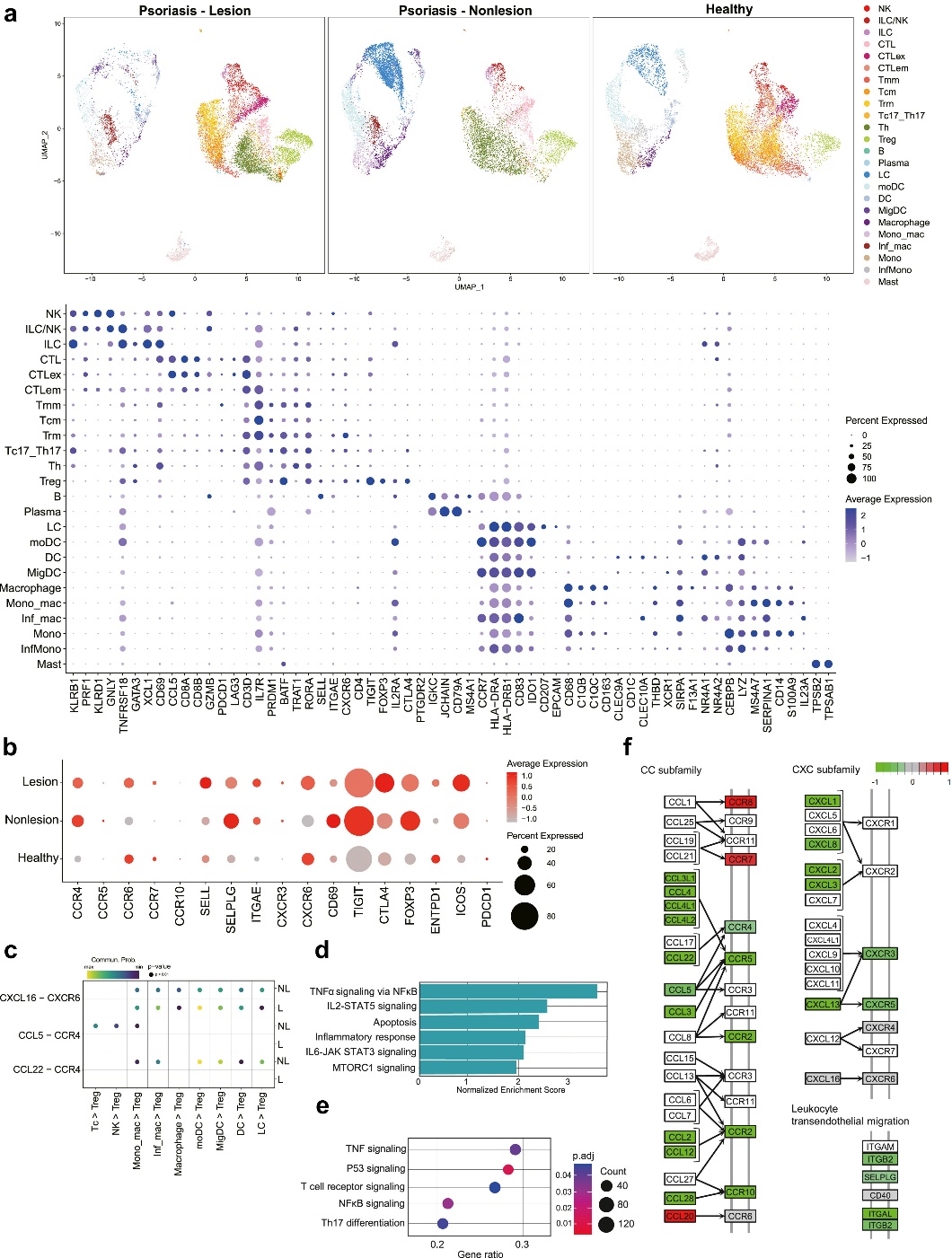
进一步利用公共数据库的 scRNA-seq 数据集,比较银屑病患者和正常人的病变皮肤和非病变皮肤活检的免疫细胞谱。研究人员发现银屑病病变皮肤和非病变皮肤 Tregs 均表现出更高的 CCR4 和 SELPLG 表达(图 5b)。与非病变皮肤相比,病变皮肤 Tregs 显示 CCR4 和 SELPLG 表达降低,CCR7 的表达增加,这与前期循环 Treg CyTOF 数据中获得的结果高度一致。
单细胞配体-受体相互作用分析表明 CCL5-CCR4 和 CCL22-CCR4 的特异性配体-受体相互作用在非病变皮肤的 Tregs 中显著富集,而这些相互作用在病变皮肤 Tregs 中不显著(图 5c)。基于 MSigDB 数据库的 GSEA-GO 和 -KEGG 通路分析表明,TNF-α 和 Th17 信号通路等典型表型在病变皮肤Tregs 中上调。与基因表达谱一致,KEGG 通路分析显示病变皮肤 Tregs 中 CCR7 表达增加,CCR4 和 SELPLG 表达降低(图 5f)。它还揭示了与非病变皮肤 Tregs 相比,病变皮肤Tregs 中的细胞粘附相关基因、 ITGB2 、 SELPLG 和 ITGAL 减少。总的来说,这些结果有力支持银屑病 Tregs 的特征是皮肤迁移特性受损,这可能导致在银屑病炎症中 Tregs 的免疫抑制效果不佳。
本研究通过高通量流式细胞分析确定了健康对照与银屑病患者循环 Tregs 和 CLA+ Tregs 的免疫表型的差异。 CyTOF 和 scRNA-seq 数据的综合结果表明,银屑病 Tregs 的皮肤迁移效率低下,导致不理想的免疫抑制环境,且难以控制持续的银屑病皮肤炎症。需要进一步研究银屑病 Tregs 皮肤迁移特性受损的潜在机制,并制定治疗策略以促进 Treg 在局部炎症组织中的募集和滞留,有利于发挥其免疫抑制功能并调控银屑病的炎症微环境。
撰文:段燕婷
审核: 周伏圣
参考文献
[1] Lee, Brian Hyohyoung et al. “High-dimensional profiling of regulatory T cells in psoriasis reveals an impaired skin-trafficking property.” EBioMedicine vol. 100 (2024): 104985. doi:10.1016/j.ebiom.2024.104985
