黑色素瘤是最常见的皮肤癌症之一,具有侵袭性,有着高的转移率和差预后,并表现出强大的治疗耐药性。其目前公认的分类方式主要依据发生部位,可分类为:肢端黑色素瘤(AM)、皮肤黑色素瘤(CM)及黏膜型黑色素瘤(MM)。驱动黑色素瘤患者癌症表型的基因改变机制尚不清楚。黑色素瘤的高免疫源性使得免疫检查点阻断治疗成为临床治疗一线选择,而其高遗传异质性则引起了患者的不同治疗效果。因此联合分析黑色素瘤的遗传和免疫机制,确定新的可药物基因组改变并确定其对肿瘤免疫微环境的影响是很重要的。
2024年7月,复旦大学人类表型组研究院副院长丁琛教授团队在Cell Discovery期刊上发表了一篇题为"Proteogenomic insights into the biology and treatment of pan-melanoma"的研究论文,该研究展示了一个全面的黑色素瘤(包括了AM,CM,MM)蛋白质组学观,建立了黑色素瘤依托蛋白组学和免疫学新分类,系统的说明了驱动基因改变的功能机制及对预后治疗等影响患者预后和生活质量因素的影响。
文章主要结果和发现
该研究首先对纳入实验的164例黑色素瘤(28例CM,81例AM,28例MM和已转移黑色素瘤27例)和43例正常痣对照(图1a,b)有选择的进行了基因组、转录组、蛋白组和磷酸化蛋白质组水平分析(图1c)。对于黑色素瘤来说最常见的单核苷酸变异是胞嘧啶向胸腺嘧啶转变(C>T)(图1d,e)。随后发现了4个显著的突变标记,其中SBS7a(紫外线损伤相关)与患者的临床结果显著相关(图1f,g)。SBS7a+与DNA修复通路相关,高表达PRKDC等蛋白,SBS7a+组中拷贝数变异(CNAs)的对同源转录组和蛋白质组的影响更深远(图1h-k)。总体描绘了黑色素瘤的蛋白基因图谱。
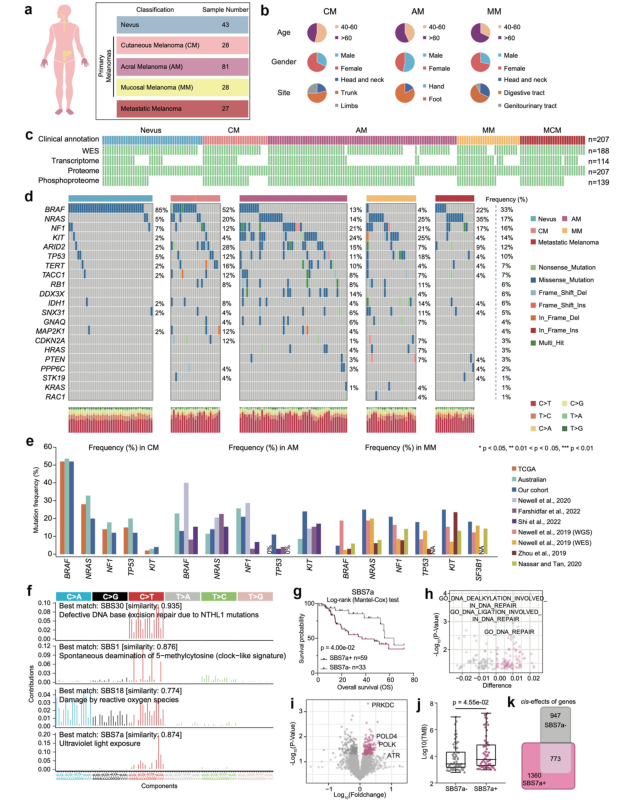
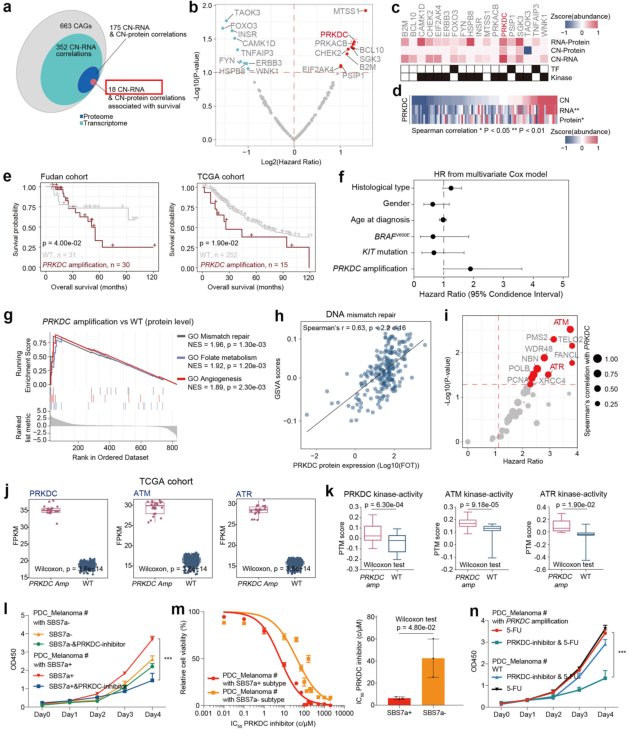
随后为了发现CNA区域的功能性基因,联合蛋白质和转录组数据筛选出了18个癌症相关基因,其中MTSS1和PRKDC基因是与患者预后最相关的(图2a-e)。PRKDC基因扩增是黑色素瘤预后中最显著的预测因子,其同源蛋白的表达影响DNA修复、DNA错配修复等,且与ATM、ATR等DNA损伤修复相关蛋白高度相关,PRKDC可与ATM和ATR协同上调DNA损伤修复并导致不良预后(图2f-k)。通过调查已批准癌症治疗中阻断DNA合成的药物,研究发现PRKDC表达的增强可能会抑制5-FU治疗的效果。PRKDC是SBS7a+患者组中表达最显著的蛋白之一,系列的联合分析指出在临床治疗过程中SBS7a+患者可从PRKDC抑制剂和5-FU联合治疗中获益(图2l-n)。
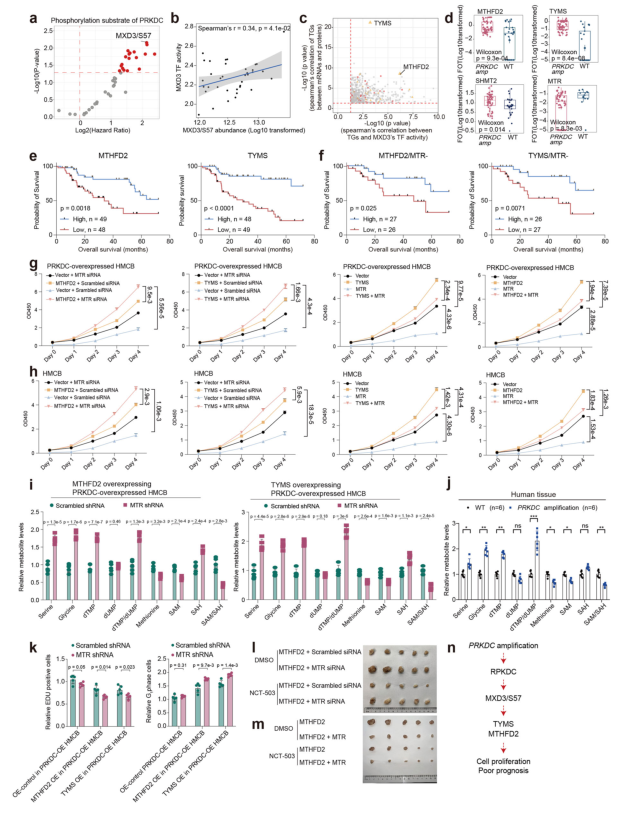
生存分析筛选出了PRKDC生存相关的磷酸化底物MXD3的S57位磷酸化,关联分析中PRKDC基因扩增的患者中MTHFD2和TYMS的蛋白升高,PRKDC对MXD3的磷酸化有调控作用,而MXD3参与MTHFD2和TYMS的上游调控,且他们都参与叶酸循环代谢,指出改变PRKDC的表达可以影响叶酸代谢的关键酶(图3a-d)。接下来通过系列功能实验来探索这些与叶酸通路相关的蛋白改变是否与PRKDC核苷酸改变影响下的预后有关联,最终数据指出,MTR缺失联合MTHFD2上调导致单碳单元富集,并通过PRKDC-MXD3/s57途径诱导的黑色素瘤肿瘤生长(图3e-n)。
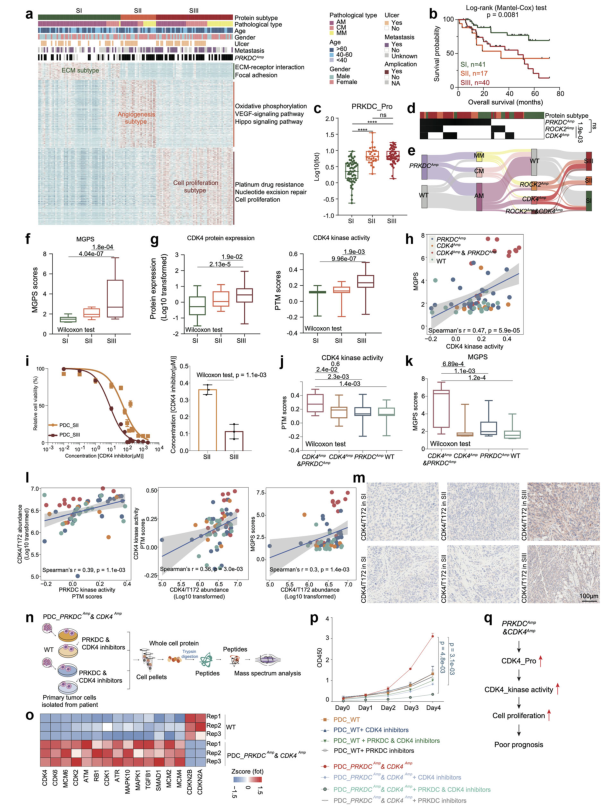
蛋白组数据聚类分出了3个亚组S-I(ECM亚型), S-II(血管生成型)和 S-III(细胞增值亚型),有意思的是三组患者的总生存期(OS)差别非常大(图4a-e)。在S-II和S-III中PRKDC的表达显著高于S-I,与其它类型相比S-III表现出更高的多基因增值评分(MGPSs)除此之外SS-III中的CDK4基因扩增频率也有提高(图4f-m)。SS-III患者的原代肿瘤细胞培养显示了对CDK4抑制剂的敏感性,细胞学实验证实PRKDC可以增强CDK4激酶活性促进S-III亚型肿瘤细胞增殖的能力,提示临床治疗联合使用CDK4和PRKDC抑制剂,可使S-III期患者受益(图4n-q)。
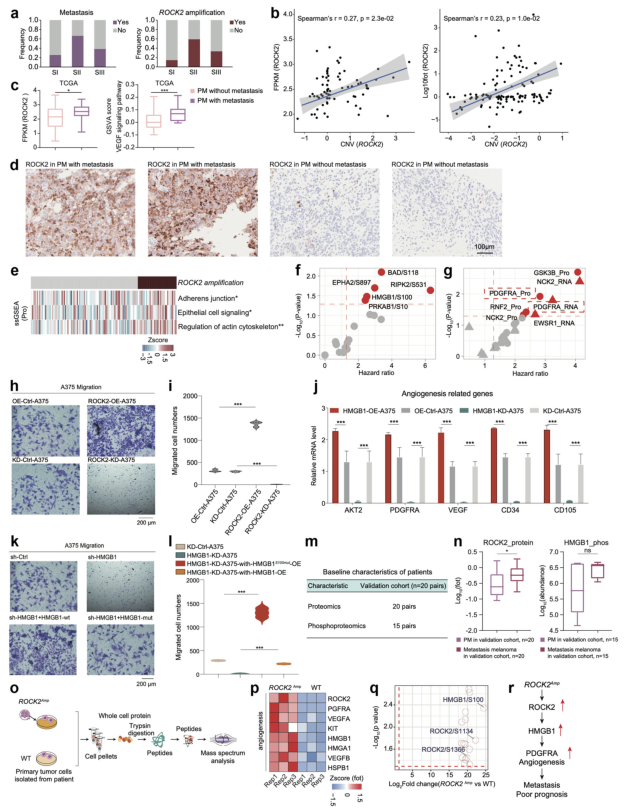
与其它类型相比S-II患者具有更好的复发转移率,癌症相关基因分析展示其ROCK2基因扩增频率增高,研究推测ROCK2的扩增可促进原发黑色素瘤的转移。磷酸化蛋白质组数据筛选出ROCK2与转录因子HMGB1的S118位磷酸化负相关,HMGB1报告可促进血管生成,细胞学实验数据表明S-II亚群中ROCK2的升高扩增可能是血管生成升高的原因,并可能作为黑色素瘤转移的可能预测标志物(图5)。
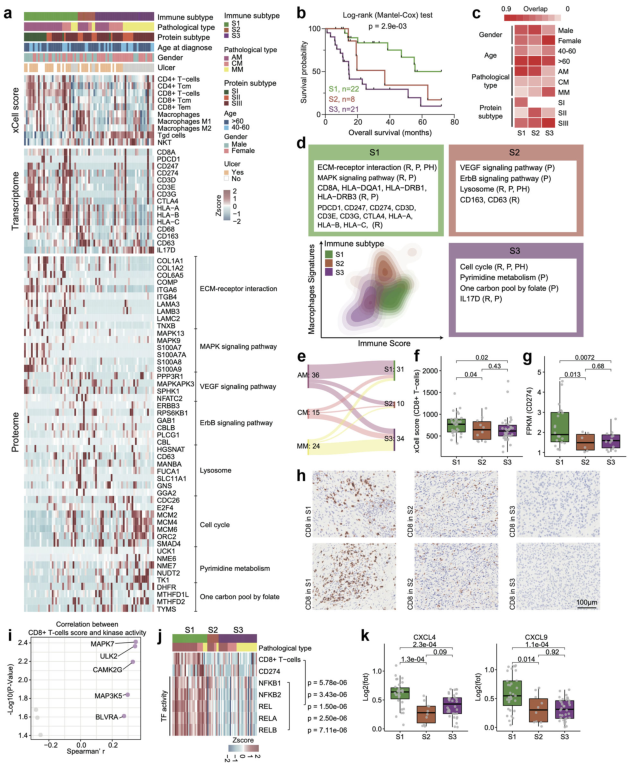
免疫治疗作为黑色素瘤的一线选择,为了更好了解黑色素瘤免疫浸润的特点,基于RNA-seq数据,推断肿瘤微环境中不同细胞类型比例,最终分出了具有不同免疫特征的三种亚型(S1,S2,S3)。生存分析提示三组分型的OS差别极大。本研究纳入的约50%的AM患者均属于S1型,绝大部分的MM则属于S3型(图6a-c)。综合分析三种亚型的特征表现,S1型可称T细胞亚型,S2型可称为TAM型,S3可称为IL-17分泌亚型。研究观察到S1亚型中PDL1表达升高和CD8+ T细胞高富集,随后比较了三种分型的分子特征,发现了MAPK信号通路和NFκB信号通路与CD8+ T细胞特征评分呈正相关,综合表明,MAPK7激酶活性的升高可能会增强NFκB2的TF活性,进而增加细胞因子的表达和CD8+ T细胞的募集,提示属于S1亚型的患者可更有利于免疫治疗(图6d-k)。
对于黑色素瘤的免疫亚型和蛋白亚型两者都与OS有很强的关联性,推测两种分型之间似乎也有很强的关联性。基于蛋白质组学和免疫亚型特征的进行分层聚类,将蛋白质组学和免疫亚型整合为一个更精细的组类(HC1,HC2, HC3, HC4, andHC5)。有趣的是,这些更精细的分组暗示了研究中相同的蛋白质组亚型会具有不同的免疫组(HC1: SI-S1;HC2: SII-S2;HC3: SII-S3;HC4: SIII-S1;HC5: SIII-S3)。
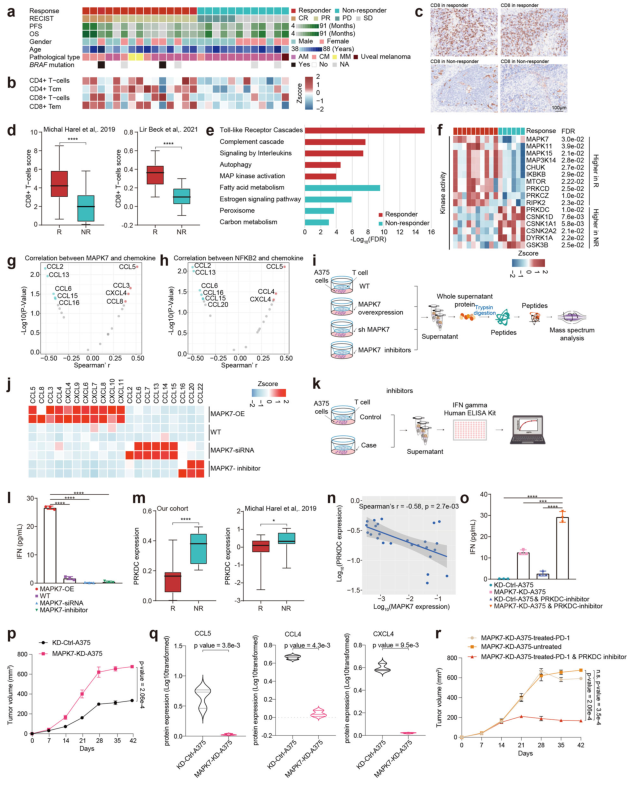
最后研究为了进一步说明以上发现的各类功能性改变与黑色素瘤免疫治疗效率之间的潜在关系,用27例接受过抗PD-1治疗的Ⅳ期黑色素瘤患者构建了一个独立的验证队列,并根据患者对治疗的反应分成了反应组和无应答组。对所有患者治疗前均进行了蛋白质组学和蛋白磷酸化组学分析(图7a-f)。结合细胞学功能实验提示MAPK7/NFκB2级联激活有助于增加参与募集CD8+细胞的细胞因子的表达,促进免疫治疗;与单独PD-1治疗相比,PRKDC和PD-1抑制剂的联合治疗可显著降低了肿瘤生长,证实了未来使用PRKDC抑制剂与抗PD-1抗体联合治疗黑色素瘤的潜力(图7g-r)。
本文总结和意义
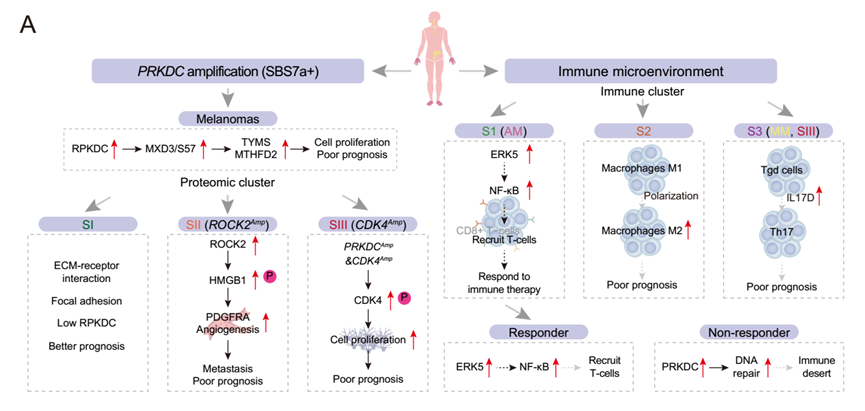
PRKDC扩增是黑色素瘤的预后分子。PRKDC扩增的顺式效应可能通过激活DNA修复和叶酸代谢途径导致肿瘤增殖。基于蛋白质组学的原发性黑色素瘤分层定义了三种与预后相关的亚型,即ECM亚型、血管生成亚型(具有高转移率)和细胞增殖亚型,免疫分类确定了三种免疫亚型。进一步的分析结合一个独立的抗pd -1治疗队列显示,上调MAPK7-NFKB信号通路可能促进T细胞募集,增加患者对免疫治疗的敏感性。PRKDC可能通过促进黑色素瘤细胞的DNA修复来降低黑色素瘤患者对免疫治疗的敏感性(图S10)。
本研究给大家展示了一个全面的黑色素瘤蛋白质组学景观,包括肢端,皮肤和粘膜类型。提供了一个资源来说明驱动基因组改变的功能机制,是如何影响患者生存、治疗和其他影响患者预后和生活质量临床因素的,这些结果强调了多组学数据的临床价值可提高对黑色素瘤治疗的理解。
供稿:陈梦云
参考文献:Xiang H, Luo R, Wang Y, Yang B, Xu S, Huang W, Tang S, Fang R, Chen L, Zhu N, Yu Z, Akesu S, Wei C, Xu C, Zhou Y, Gu J, Zhao J, Hou Y, Ding C. Proteogenomic insights into the biology and treatment of pan-melanoma. Cell Discov. 2024 Jul 23;10(1):78.
