
【最新成果】2025年6月,安徽医科大学第一附属医院皮肤性病科、皮肤病学教育部重点实验室联合中国科学技术大学及上海交通大学医学院等多家单位,在国际肿瘤免疫领域权威期刊Journal for ImmunoTherapy of Cancer(IF=10.6)在线发表题为“Ectopic expression of GDF15 in cancer-associated fibroblasts enhances melanoma immunosuppression via the GFRAL/RET cascade”的研究论文。该研究深入解析了肿瘤相关成纤维细胞(CAFs)在黑色素瘤免疫抑制过程中的关键调控机制,拓展了我们对皮肤恶性肿瘤微环境调控机制的认知。
研究亮点一:发现CAF中一个高表达GDF15的新亚群
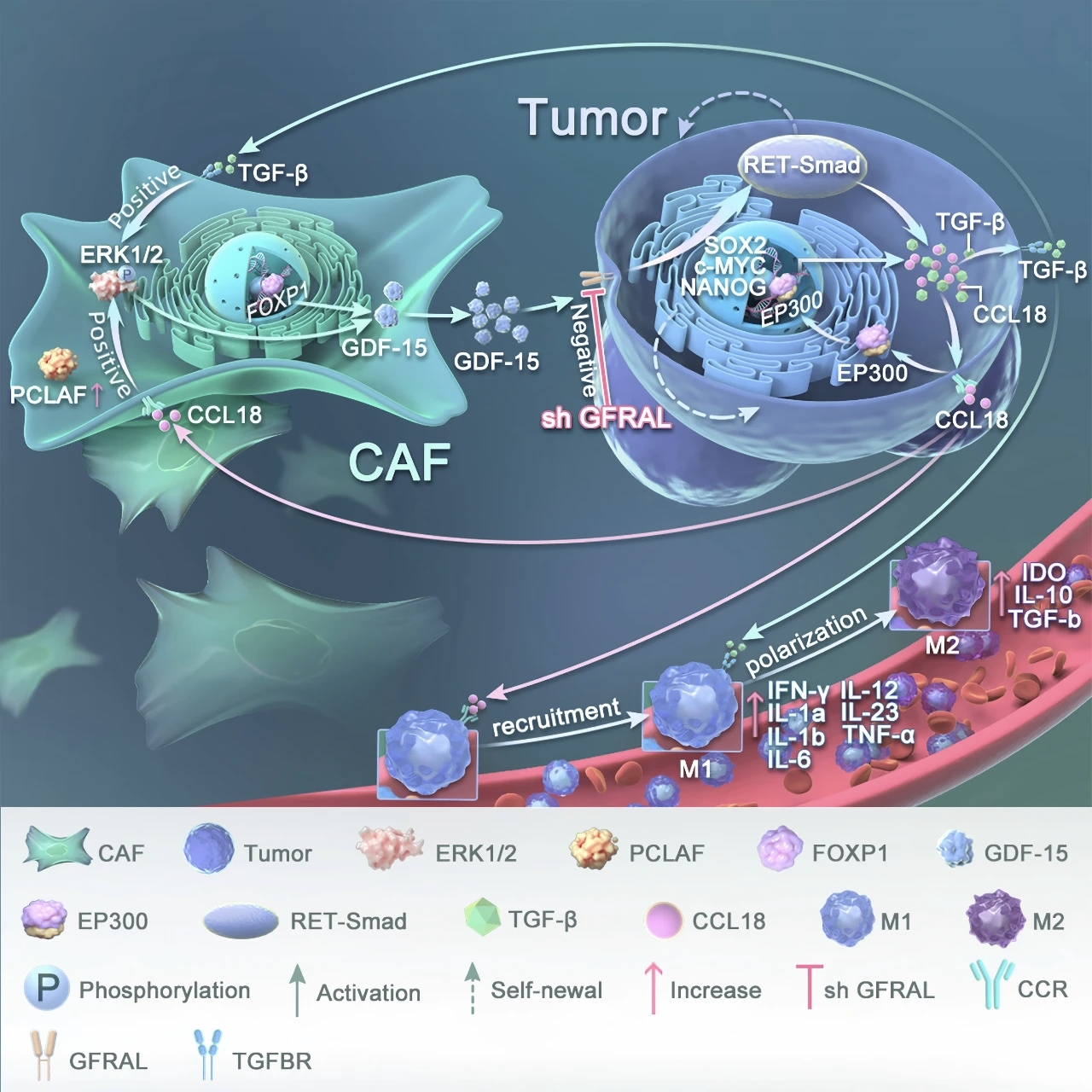
通过单细胞转录组与空间转录组联合分析,团队识别出一个特异性表达生长分化因子15(GDF15)的CAF亚群(C2 GDF15⁺ CAFs)。该亚群表现出明显的干性与较强的分化潜能,富集于肿瘤边缘区域,提示其在黑色素瘤进展中具有关键作用。
研究亮点二:GDF15经GFRAL/RET轴调控黑色素瘤细胞干性
基础实验显示,CAF分泌的GDF15通过GFRAL受体结合激活RET/AKT/ERK1/2通路,显著增强黑色素瘤细胞的克隆形成能力、球体形成能力及干性因子(如SOX2、MYC)表达。敲低GFRAL或GDF15后,干性及增殖能力明显减弱。
研究亮点三:GDF15诱导炎症因子释放,驱动免疫抑制塑形
CAF分泌的GDF15不仅作用于肿瘤细胞,还诱导其分泌炎症因子CCL18与TGF-β,促进外周单核细胞招募并极化为M2型巨噬细胞,增强免疫抑制微环境的稳定性。流式分析与动物模型进一步验证了GDF15/RET/Smad通路在调控巨噬细胞极化和肿瘤进展中的关键作用。
该研究为皮肤源性肿瘤免疫微环境的基础研究提供了新的方向,并提示靶向GDF15/GFRAL/RET通路可能成为未来黑色素瘤免疫治疗的新策略。安徽医科大学第一附属医院皮肤性病科、皮肤病学教育部重点实验室丁延涛博士为论文通讯作者,上海交通大学医学院附属第九人民医院赵志杰副教授、安徽医科大学第一附属医院神经外科研究生蔡华宝等为共同第一作者。
原文链接:https://doi.org/10.1136/jitc-2024-011036
供稿:丁延涛
